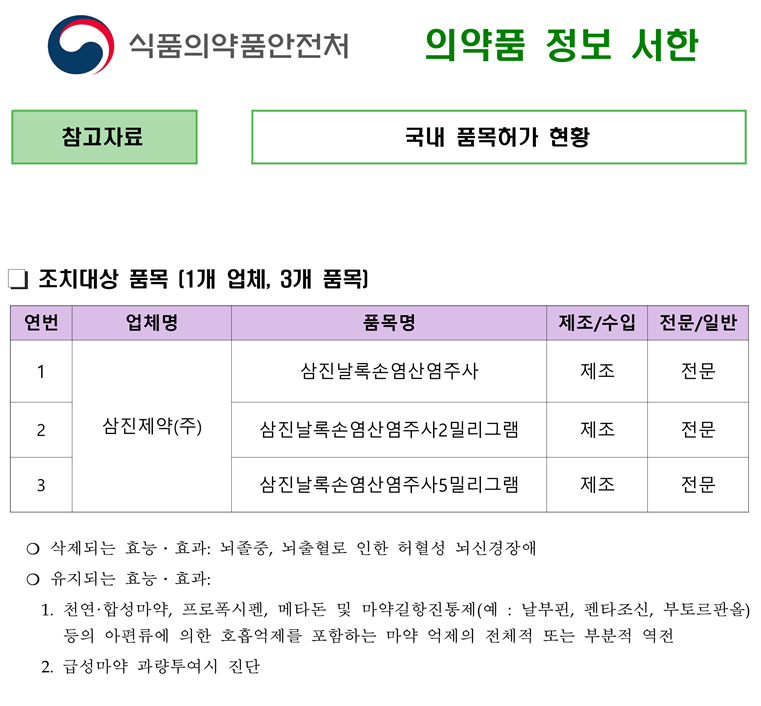
식약처는 ‘날록손염산염’ 주사제에 대해 안전성에는 문제가 없으나(재평가 자료와 중앙약사심의위원회 자문 내용을 종합·평가한 결과) ‘뇌신경장애’ 효능·효과를 입증하지 못해 행정조치 진행 (「의약품 재평가 실시에 관한 규정」(식약처 고시)에 따라 재평가 시안 열람(20일), 이의신청 기간(10일) 부여 및 결과 공시(해당 효능·효과 삭제) 등의 후속 행정절차 진행 예정) 이전에 일선 의료현장에서 해당 치료 목적으로 사용되지 않도록 선제적으로 조치했다.
이러한 차원에서 식약처는 의약품 정보 서한을 통해 의·약사 등 전문가가 ‘뇌졸중, 뇌출혈로 인한 허혈성 뇌신경장애’ 환자에게 다른 의약품을 처방·조제하도록 협조 요청했으며, 환자들에게도 이와 관련하여 의·약사와 상의할 것을 당부했다.
아울러 보건복지부와 건강보험심사평가원 등 관련 기관에도 해당 품목의 의약품 정보 서한을 전달했다.
식약처는 앞서 「약사법」 제33조에 따라 ‘날록손염산염’ 제제의 허가된 효능·효과 중 효과 확인이 필요한 ‘뇌졸중, 뇌출혈로 인한 허혈성 뇌신경장애’에 대해 관련 업체에 국내 임상시험을 거쳐 최신의 과학 수준에서 효과를 재평가하도록 조치했다고 말했다.
이에 따라 업체는 동 제제에 대한 임상시험을 실시하고 그 결과를 제출했으나, 그 효과를 입증하지 못한 것이다.
참고로 ‘날록손염산염’ 주사제 나머지 효능·효과 (천연·합성마약, 프로폭시펜, 메타돈 및 마약길항진통제(예 : 날부핀, 펜타조신, 부토르판올) 등의 아편류에 의한 호흡억제를 포함하는 마약 억제의 전체적 또는 부분적 역전 ) 는 현재와 동일하게 유지됩니다.
식약처는 앞으로도 최신의 과학 수준에서 의약품에 대한 안전성과 효과성을 지속적으로 재평가해 국민이 안심하고 의약품을 사용할 수 있도록 최선을 다하겠다고 말했다.






















































댓글
(0)